Conversion électrochimique
- 1. Piles et accumulateurs en décharge
- a. Définition
Une pile est un système électrochimique stockant de l'énergie sous forme chimique et capable de la restituer sous forme électrique.
Un accumulateur (d'énergie électrique) est une pile pouvant être rechargée.
Pile en décharge :
Oxydation (anode) :
Réduction (cathode) :
Réaction globale spontanée :
La séparation empêche la réaction directe entre et .
- 1. Piles et accumulateurs en décharge
- a. Définition
- b. Exemples
Pile de Volta : empilement de disques de cuivre et de zinc séparés par du papier imbibé d'acide.
Oxydation sur le zinc : .
Réduction sur le cuivre : .
Inconvénient : dégagement de gaz entre les disques.
Vocabulaire :
- Pile : un système à deux électrodes.
- Batterie : plusieurs piles en série.
Mais en anglais, battery désigne une pile ou un accumulateur.
Pile zinc-bioxyde de manganèse (pile alcaline).
Pile à hydrogène :
Réaction globale : combustion de l'hydrogène.
Intérêt : l'hydrogène est apporté comme un combustible (pas de recharge électrique).
- 1. Piles et accumulateurs en décharge
- a. Définition
- b. Exemples
- c. Étude thermodynamique
Travail reçu par la pile (négatif) :
Variation d'enthalpie libre de la pile à T et P constantes
Tension aux bornes de la pile ?
La tension est plus faible que la force électromotrice, d'autant plus que le courant est intense.
- 1. Piles et accumulateurs en décharge
- a. Définition
- b. Exemples
- c. Étude thermodynamique
- d. Courbe de décharge
: pile neuve ou accumulateur rechargé.
: équilibre chimique de la réaction globale, pile déchargée (\(e=0\)).
Courbe de décharge : force électromotrice en fonction de la quantité de charge débitée .
Attention : lorsqu'on mesure la f.é.m., les électrodes sont à l'équilibre et ont donc le potentiel de Nernst mais la réaction globale n'est pas à l'équilibre si \(e>0\).
Capacité : quantité de charge débitée lorsque la pile est déchargée
Capacité indiquée : quantité de charge débitée lorsque la f.é.m. passe en dessous d'un seuil.
Ordre de grandeur pour une pile au format AA :

La capacité dépend :
- de la taille de la pile,
- de la température,
- de l'intensité du courant,
- du nombre de recharges déjà effectuées.
Accumulateur : pile pouvant supporter un grand nombre de recharges (100 à 1000) avec une perte de capacité acceptable.
- 1. Piles et accumulateurs en décharge
- a. Définition
- b. Exemples
- c. Étude thermodynamique
- d. Courbe de décharge
- e. Étude cinétique
Courbes courant-potentiel idéales (sans chute ohmique) pour chaque demi-pile.
Intensité anodique opposée à l'intensité cathodique.
: surpotentiel anodique.
: surpotentiel cathodique.
: résistance de l'électrolyte (avec la jonction).
Irréversibilité de la transformation :
: chute de tension cinétique, due au transfert de charges et à la diffusion des espèces électroactives.
: chute de tension ohmique, due à la résistance de l'électrolyte.
Modèle linéaire (couples rapides) :
Résistance interne de la pile .
Relation tension-courant linéaire :
Modèle électrique équivalent.

- 1. Piles et accumulateurs en décharge
- a. Définition
- b. Exemples
- c. Étude thermodynamique
- d. Courbe de décharge
- e. Étude cinétique
- f. Rendement de la conversion
Énergie chimique :
- convertie en énergie électrique,
- dissipée dans la pile (irréversibilité).
Évolution de la pile entre deux états :
: travail électrique fourni (positif).
Variation d'énergie chimique (négative) :
Rendement de la conversion :
Le rendement est maximal lorsque (courant nul).
Proche de 1 car l'effet entropique est généralement faible.
Le rendement diminue lorsque le courant augmente. L'énergie chimique non convertie est perdue par irréversibilité dans la pile (résistance électrique et surpotentiel cinétique).
- 2. Recharge et électrolyse
- a. Définition
Recharge d'un accumulateur : conversion d'énergie électrique en énergie chimique. Les réactifs sont regénérés presque complètement.
Électrolyse : production d'une espèce par une réaction d'oxydoréduction non spontanée.
Intensité du courant : .
Pile en recharge (ou électrolyse):
Réduction (cathode) :
Oxydation (anode) :
Réaction globale non spontanée :
mais .
- 2. Recharge et électrolyse
- a. Définition
- b. Étude thermodynamique
Variation d'enthalpie libre du système :
Travail reçu (positif) :
Tension aux bornes de l'accumulateur :
La tension est plus grande que la force électromotrice, d'autant plus que la recharge est rapide.
- 2. Recharge et électrolyse
- a. Définition
- b. Étude thermodynamique
- c. Étude cinétique
: surpotentiel cathodique.
: surpotentiel anodique.
: résistance de l'électrolyte.
Irréversibilité de la transformation :
Modèle linéaire (couples rapides) :
Résistance interne de l'accumulateur
Relation tension-courant linéaire :
Modèle électrique équivalent.
- 2. Recharge et électrolyse
- a. Définition
- b. Étude thermodynamique
- c. Étude cinétique
- d. Rendement de la conversion
Énergie électrique :
- convertie en énergie chimique,
- dissipée dans l'accumulateur (irréversibilité).
Évolution de l'accumulateur entre deux états :
: travail électrique reçu (positif).
Variation d'énergie chimique (positive) :
Rendement de la conversion :
Le rendement est maximal lorsque (courant nul).
Proche de 1 car l'effet entropique est généralement faible.
Le rendement diminue lorsque le courant augmente. L'énergie électrique non convertie est perdue par irréversibilité dans l'accumulateur (résistance électrique et surpotentiel cinétique).
Électrolyse industrielle : obtenir le plus de matière possible en un temps donné avec le moins d'énergie possible.
Développement d'électrodes pour réduire les surpotentiels.
- 2. Recharge et électrolyse
- a. Définition
- b. Étude thermodynamique
- c. Étude cinétique
- d. Rendement de la conversion
- e. Électrolyse de l'eau
Intérêt : production de dihydrogène pour les piles à hydrogène (équivalent à une recharge de la pile).
Nécessité d'un sel de fond pour réduire la résistance de l'électrolyte.
Exemple : solution d'acide sulfurique 0,5 mol⋅L-1 (beaucoup plus concentré en industriel).
Courbes courant-potentiel avec une électrode de référence entre les deux électrodes de platine (prise en compte de ).
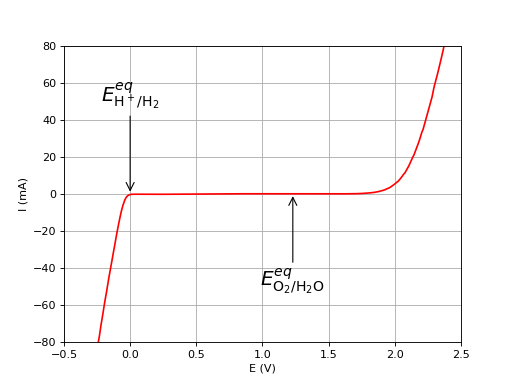
Seuil de tension pour déclencher l'électrolyse :
Production de moles de :
Plus est grand, plus l'énergie à fournir est grande (augmentation des pertes par irréversibilité).
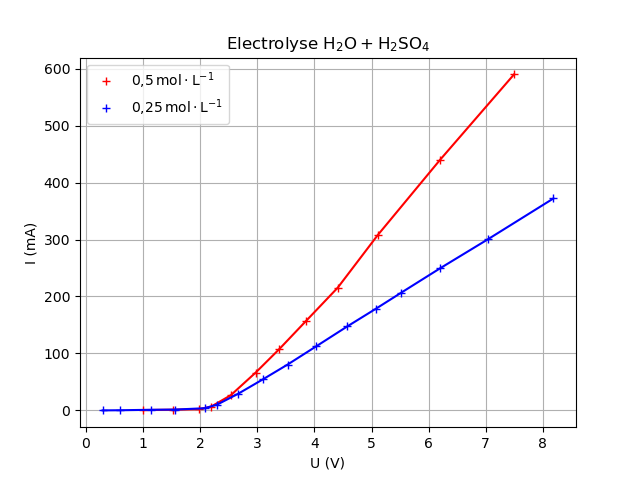
Rendement énergétique :
Intérêt de réduire le seuil de surpotentiel d'oxydation de l'eau.
Rendement faradique de production d'une espèce : quantité de matière obtenue sur quantité de matière prévue si tous les électrons sont utilisés dans la réaction. Il est inférieur à \(100\,\%\) en présence de réactions indésirables sur l'électrode.
\(N\) : quantité molaire obtenue de l'espèce \(A\) souhaitée.
Il faut \(n\) électrons pour oxyder ou réduire \(A\).
Rendement faradique :
Sur la cathode : réduction de seulement. Le rendement faradique de production de \(\rm{H_2}\) est \(100\,\%\).
Sur l'anode, le rendement faradique de production de \(\rm{O_2}\) peut être inférieur à \(100\,\%\) à cause de :
Détermination expérimentale des rendements :
\(N\) : quantité molaire obtenue d'un produit de l'électrolyse.
\(\xi\) : avancement effectif de la réaction.
Électrolyse de l'eau :