Equilibre chimique¶
Avancement d’une réaction à l’équilibre¶
Capacité numérique : Déterminer l’état final d’un système, siège d’une transformation, modélisée par une ou deux réactions à partir des conditions initiales et valeurs des constantes d’équilibre.
Considérons la réaction en phase gazeuse suivante (production de dihydrogène à partir du méthane) :
On suppose que la réaction est réalisée à une température \(T\) et à une pression \(P\) fixées. La constante d’équilibre à cette température est \(K^{\circ}(T)\).
Initialement, on met en présence 1 mole de méthane pour n moles d’eau. Le quotient de réaction s’écrit :
où \(x\) désigne l’avancement de la réaction. La pression est exprimée en bars. L’équation algébrique à résoudre pour déterminer l’avancement à l’équilibre est \(Q_r(x)=K^{\circ}\), qui peut s’écrire sous la forme d’une équation polynomiale.
Il peut être intéressant de considérer l’enthalpie libre de la réaction :
L’équation algébrique est alors \(\Delta_rG^{\circ}(x)=0\). L’avancement maximal est déterminé par le réactif en défaut donc la solution est à rechercher dans l’intervalle \([0,\min(1,n)]\).
Les constantes sont définies dans des variables globales. Une fonction permet de calculer \(\Delta_rG\) :
1 2 3 4 5 6 7 8 9 10 | import numpy as np
import matplotlib.pyplot as plt
from scipy.optimize import bisect
R = 8.31 # J/K/mol
DrH0 = 206 # kJ/mol
DrS0 = 216 # J/K/mol
def DrG(x,n,T,P):
return DrH0*1e3-T*DrS0+R*T*(np.log(27*x**4*P**2)-np.log((1-x)*(n-x)*(n+1+2*x)**2))
|
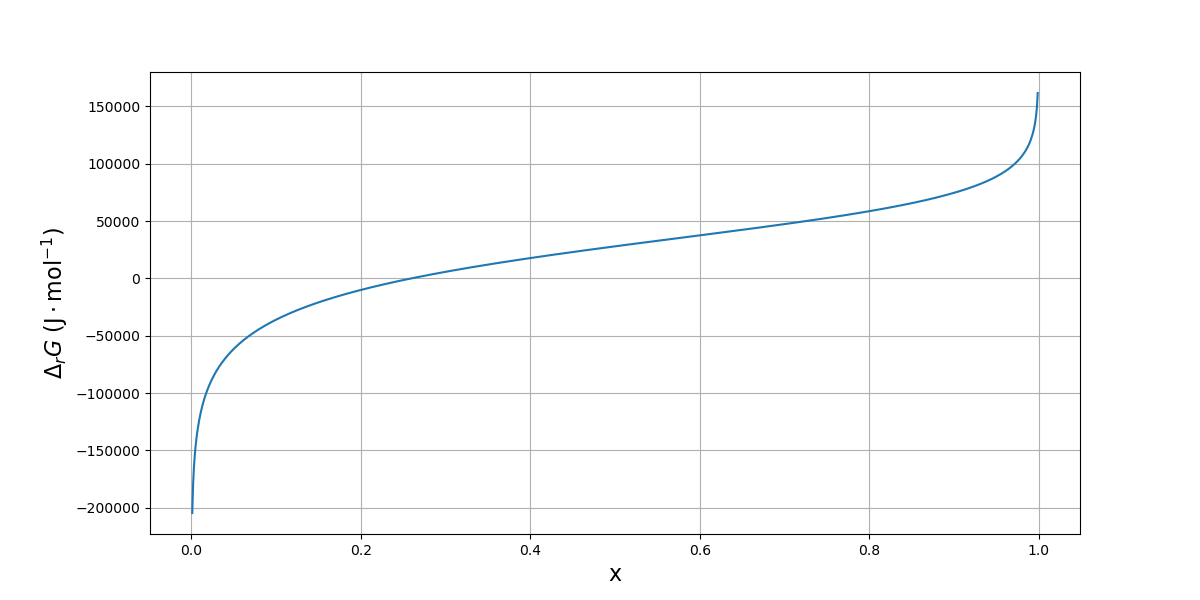
Voici une représentation graphique de \(\Delta_rG\) en fonction de l’avancement, pour \(T,P,n\) donnés :
1 2 3 4 5 6 7 8 9 10 11 12 | T = 1100
P = 30
n = 1
xmax = min(1,n)
x = np.linspace(1e-3,xmax-1e-3,1000)
G = DrG(x,n,T,P)
plt.figure(figsize=(12,6))
plt.plot(x,G)
plt.grid()
plt.xlabel('x',fontsize=16)
plt.ylabel(r'$\Delta_rG\ (\rm J\cdot mol^{-1})$',rotation=90,fontsize=16)
plt.show()
|
L’avancement à l’équilibre peut être déterminé graphiquement avec une précision suffisante mais, pour automatiser la détermination de la racine, nous allons utiliser la méthode de dichotomie, au moyen de la fonction scipy.optimize.bisect :
1 2 3 4 | x = bisect(DrG,0,xmax,args=(n,T,P))
print(x)
0.259595589226592
|
Voici un tracé de l’avancement en fonction de la température, pour deux valeurs différentes de \(n\) :
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 | N=100
T = np.linspace(300,1500,N)
P = 30
n1 = 1
n2 = 5
X1 = np.zeros(N)
X2 = np.zeros(N)
for i in range(N):
X1[i] = bisect(DrG,0,min(1,n1),args=(n1,T[i],P))
X2[i] = bisect(DrG,0,min(1,n2),args=(n2,T[i],P))
plt.figure(figsize=(12,6))
plt.plot(T,X1,label='n=1')
plt.plot(T,X2,label='n=5')
plt.xlabel('T (K)',fontsize=16)
plt.ylabel('x',fontsize=16)
plt.grid()
plt.legend(loc='upper right')
plt.show()
|
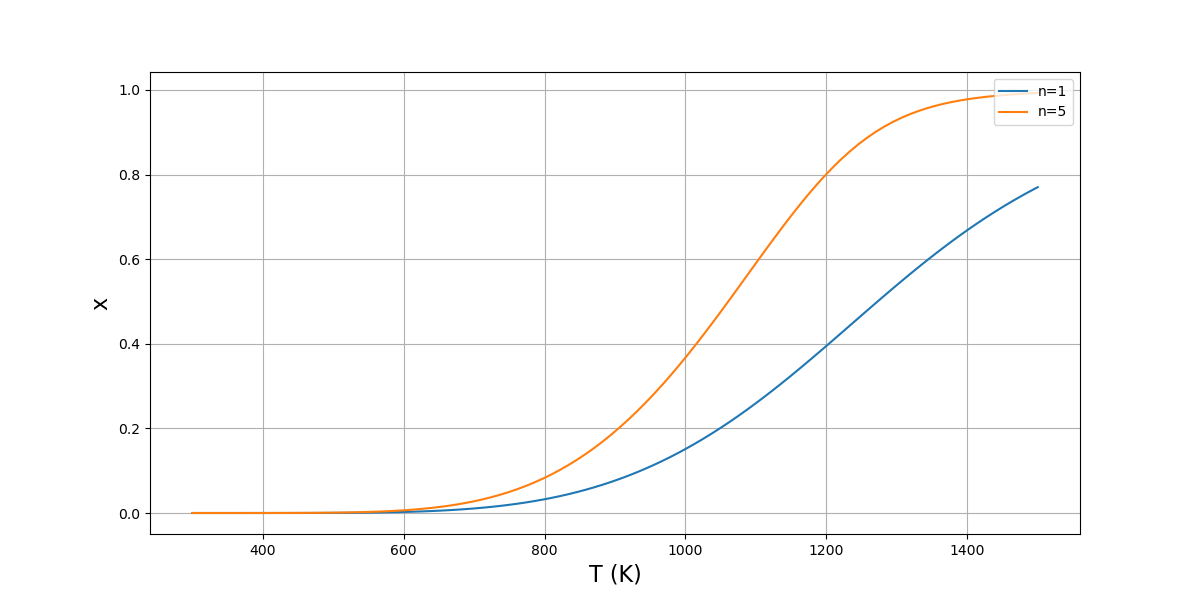
Diagramme de distribution d’un diacide¶
Capacité numérique : Tracer le diagramme de distribution des espèces d’un ou plusieurs couple(s) acide-base, et déterminer la valeur du point isoélectrique d’un acide aminé.
Soit un diacide, noté \(\rm AH_2\). Le couple \(\rm AH_2/AH^-\) a un pK égal à \({\rm p}K_1\). Le couple \(\rm AH^-/A^{2-}\) a un pK égal à \({\rm p}K_2\).
Le diagramme de distribution représente les concentrations de \(\rm AH_2,AH^-,A^{2-}\) en fonction du pH, pour une concentration apportée d’acide donnée \(C_a\). On a les trois équations suivantes :
Posons \(h=[{\rm H_3O^+}]\). Après avoir exprimé les concentrations \(\rm[A^{2-}]\) et \(\rm[AH^-]\) en fonction de \(\rm[AH_2]\), on obtient :
Ces trois relations permettent de calculer les trois concentrations en fonction du pH.
Les constantes sont définies dans des variables globales :
1 2 3 4 5 6 7 8 | import numpy as np
import matplotlib.pyplot as plt
Ca = 0.01
pK1 = 6.35
pK2 = 10.33
K1 = 10**(-pK1)
K2 = 10**(-pK2)
|
On peut définir une fonction pour chaque concentration :
1 2 3 4 5 6 7 8 9 10 11 | def AH2(pH):
h = 10**(-pH)
return Ca/(1+K1*K2/h**2+K1/h)
def AH(pH):
h = 10**(-pH)
return K1/h*AH2(pH)
def A(pH):
h = 10**(-pH)
return K2/h*AH(pH)
|
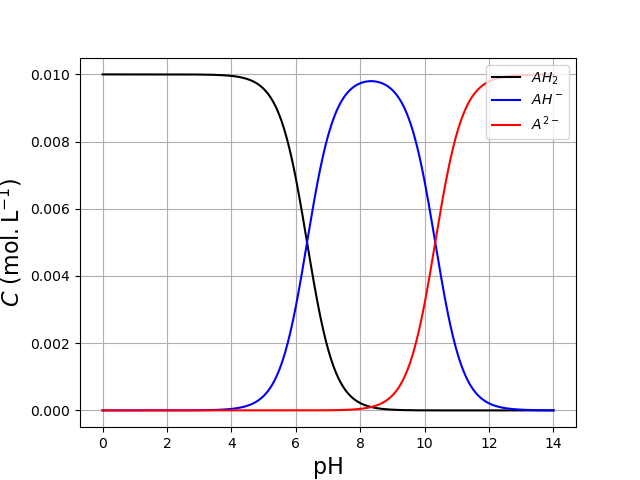
et voici le tracé du diagramme de distribution :
1 2 3 4 5 6 7 8 9 10 | plt.figure()
pH = np.linspace(0,14,500)
plt.plot(pH,AH2(pH),'k',label='$AH_2$')
plt.plot(pH,AH(pH),'b',label='$AH^-$')
plt.plot(pH,A(pH),'r',label='$A^{2-}$')
plt.grid()
plt.xlabel('pH',fontsize=16)
plt.ylabel(r'$C\ (\rm mol.L^{-1})$',rotation=90,fontsize=16)
plt.legend(loc='upper right')
plt.show()
|
Précipitation sélective d’hydoxydes métalliques¶
Capacité numérique : Déterminer les conditions optimales pour séparer deux ions par précipitation sélective.
On considère la précipitation d’un ion métallique sous la forme d’un hydroxyde :
Soit \(K_s\) le produit de solubilité de l’hydroxyde et \(pK_s=-\log(K_s)\). La concentration maximale de l’ion est \(C_0\). Le pH d’apparition du précipité est :
et pour \(pH>pH_0\), la concentration en ion est donnée par :
On définit une fonction qui calcule pC pour un pH donné :
1 2 3 4 5 6 7 8 9 10 | import numpy as np
import matplotlib.pyplot as plt
pKe = 14
def pC_MOHn(n,pKs,pC0,pH):
if pH < pKe+(pC0-pKs)/n:
return pC0
else:
return pKs+n*(pH-pKe)
|
Afin de tracer les concentrations en fonction du pH, on la convertit en fonction universelle :
1 | pC_MOHn = np.frompyfunc(pC_MOHn,4,1)
|
Considérons le cas du cobalt (\(\rm Co^{2+}\)) et du magnésium (\(\rm Mg^{2+}\)).
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 | pC0 = 2
pK1 = 14.2 #Co(OH)2
pK2 = 10.8 #Mg(OH)2
pH = np.linspace(0,14,1000)
pC1 = pC_MOHn(2,pK1,pC0,pH)
pC2 = pC_MOHn(2,pK2,pC0,pH)
plt.figure(figsize=(10,6))
plt.plot(pH,pC1,label='$Co^{2+}$')
plt.plot(pH,pC2,label='$Mg^{2+}$')
plt.grid()
plt.xticks(np.arange(15))
plt.xlabel('pH',fontsize=16)
plt.ylabel('pC',fontsize=16)
plt.legend(loc='upper left')
plt.show()
|
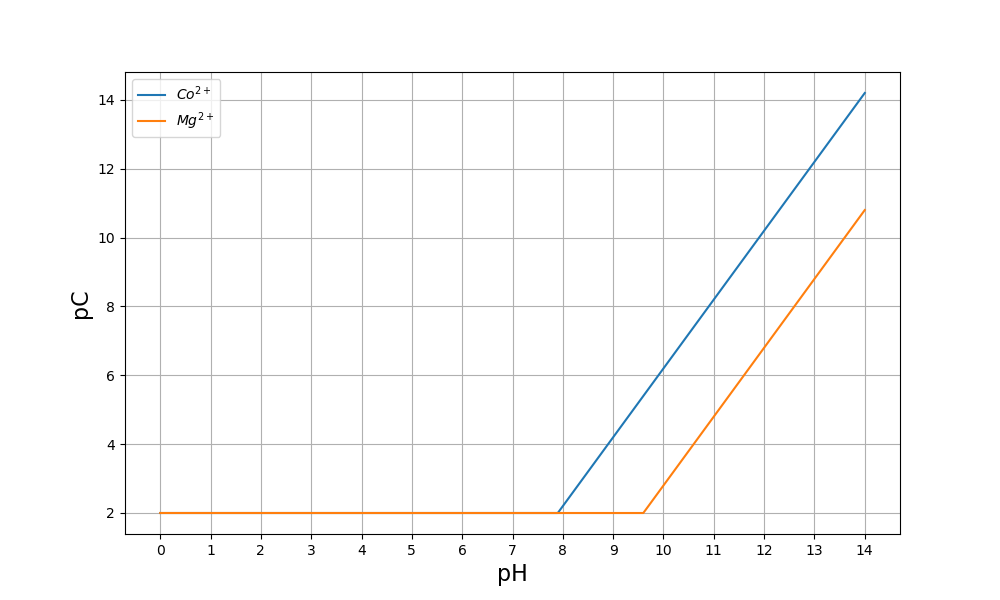
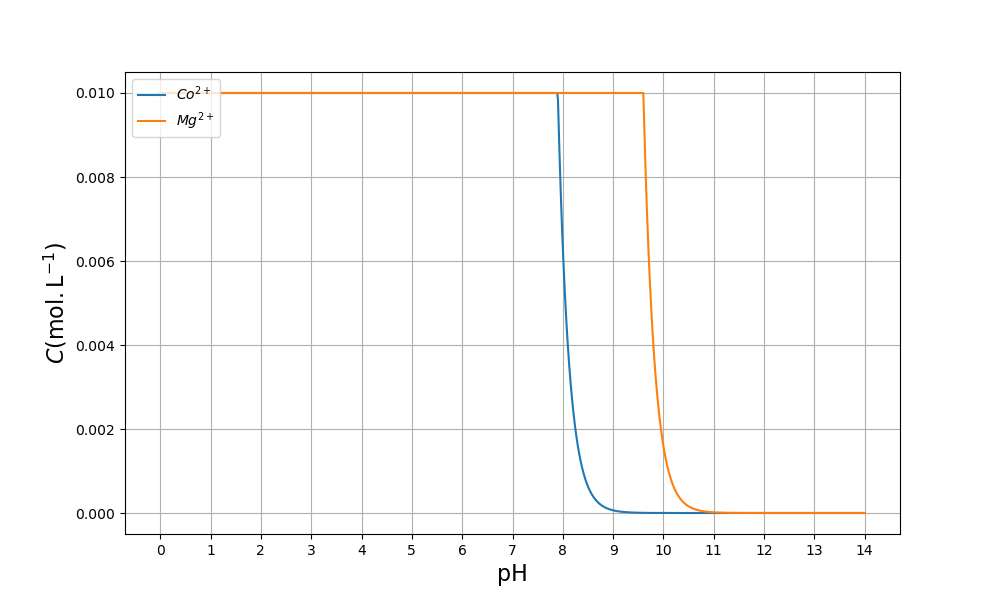
L’analyse de cette figure permet de déterminer la plage de pH qui permet de précipiter plus de 99 % du cobalt (\(pC>4\)) sans précipier le magnésium : \(8{,}9<pH<9{,}6\).
On peut aussi tracer les concentrations en échelle linéaire :
1 2 3 4 5 6 7 8 9 | plt.figure(figsize=(10,6))
plt.plot(pH,10**(-pC1),label='$Co^{2+}$')
plt.plot(pH,10**(-pC2),label='$Mg^{2+}$')
plt.grid()
plt.xticks(np.arange(15))
plt.xlabel('pH',fontsize=16)
plt.ylabel(r'$C (\rm mol.L^{-1})$',fontsize=16,rotation=90)
plt.legend(loc='upper left')
plt.show()
|